Электронная схема серы, итоговый тест 9 класс по химии с ответами

И напротив, обогащение организма подопытных животных серосодержащими соединениями, такими, как глютатион и ацетилцистеин , служащими источниками эндогенного сернистого газа, приводило не только к повышению содержания эндогенного сернистого газа, но и к уменьшению образования свободных радикалов, оксидативного стресса, воспаления и апоптоза клеток лёгочной ткани [14]. Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина вредного токсичного метаболита цистеина и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии. О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и или света.
Было установлено, что все химические свойства веществ определяются строением электронных оболочек атомов. Благодаря необычайно малой массе электрон обладает свойствами не только частицы, но и волны, т. Как частица электрон имеет определённую массу и заряд, а движущиеся электроны проявляют волновые свойства, например, поток электронов способен к дифракции, т.
Проявляя волновые свойства, электрон, может в одно и то же время находиться в разных точках пространства, поэтому электрон представляет собой не точку, а электронное облако. Электронные облака, создаваемые отдельными электронами, в сумме создают электронную оболочку атома. На каждой орбитали могут максимально разместиться два электрона, которые обладают равной энергией. Орбитали характеризуются энергией.
Несколько орбиталей, обладающих равной или близкой энергией, образуют энергетический уровень слой. Чем меньше энергия орбитали, тем ближе она расположена к ядру. Таким образом, максимальное число электронов на первом уровне — два, на втором — восемь, на третьем — восемнадцать:. Энергетические уровни, содержащие максимальное количество электронов, называются завершёнными. Если на внешнем уровне содержится меньшее количество электронов, то такой уровень называется незавершённым.
Правила заполнения электронных орбиталей. Если электронный уровень обозначить дугой и указать число электронов на каждом уровне под этой дугой, то можно составить схемы электронного строения атомов.
Например, схема электронного строения атома хлора будет иметь вид:. Связь между электронным строением атома и его положением в Периодической системе Д. Если проанализировать электронное строение атомов, связывая его с положением химического элемента в Периодической таблице Д.
Менделеева, то можно сделать следующие выводы:. Коротко о главном. Электрон имеет двойственную природу, обладая свойствами как частицы, так и волны. Область пространства вокруг ядра, где электрон находится с наибольшей вероятностью, называется электронной орбиталью. Электроны в атоме располагаются слоями в соответствии с их энергией, образуя энергетические уровни электронные слои.
Число энергетических уровней в атоме равно номеру периода, в котором находится элемент. Число электронов на внешнем энергетическом уровне у элементов главных подгрупп равно номеру группы.
Атомы элементов со сходными свойствами имеют сходное строение внешних электронных уровней. Вопросы для самоконтроля. Двойственная природа электрона. Электроны, входящие в состав атома, образуют его электронную оболочку. Именно строение электронной оболочки атома определяет свойства химического элемента. Согласно современным представлениям, электрон имеет двойственную природу и обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения.
Для описания состояния электрона в атоме используют представления квантовой механики — физической теории, устанавливающей законы движения микрочастиц. Для описания состояния электрона в атома используют четыре квантовых числа. Согласно квантово-механическим представлениям, электрон не имеет определённой траектории движения и может находиться в любой части пространства вокруг ядра, но с разной вероятностью. Каждой орбитали соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака.
Следует подчеркнуть, что любая орбиталь является объёмной. Распределение электронов по орбиталям называют электронной конфигурацией атома. Заполнение электронных орбиталей происходит в соответствии со следующими принципами. Принцип Паули. В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел , то есть не может быть даже двух абсолютно одинаковых электронов.
Два электрона, находящиеся на одной орбитали, называются спаренными или неподеленной электронной парой. Один электрон на орбитали называется неспаренным :. Правило Хунда. В основном состоянии в пределах одного подуровня атом должен иметь максимально возможное число неспаренных электронов.
Основным состоянием атома называется его наиболее устойчивое состояние, в котором электроны занимают орбитали с наименьшей энергией.
Это означает, что в пределах одного подуровня электроны заполняют орбитали сначала наполовину, а затем — полностью, при этом неспаренные электроны должны иметь одинаковое значение спинового квантового числа. Принцип наименьшей энергии. Электроны заполняют электронные орбитали в порядке увеличения их энергии.
Выявленную им закономерность можно проиллюстрировать данными таблицы. Последовательность заполнения электронных орбиталей выглядит следующим образом:. Электронные конфигурации атомов первых четырех периодов таблицы Д. Электронные конфигурации атомов. Электронные конфигурации атомов I — IV периодов периодической таблицы Д.
Особо следует отметить палладий, у которого «проскок» двух электронов:.
Завершенный внешний электронный уровень обладает наибольшей устойчивостью и обусловливает химическую инертность благородных газов. Атомы остальных химических элементов имеют незавершенные внешние электронные уровни. Электронные семейства химических элементов. Отметим, что принцип наименьшей энергии справедлив только для основного состояния атома, характеризующегося минимумом энергии.
В возбуждённых состояниях электроны могут занимать любые орбитали атома, если при этом не нарушается принцип Паули. При получении энергии извне, например, при облучении или нагревании, один или несколько электронов могут повышать свою энергию и переходить на более высокие энергетические уровни.
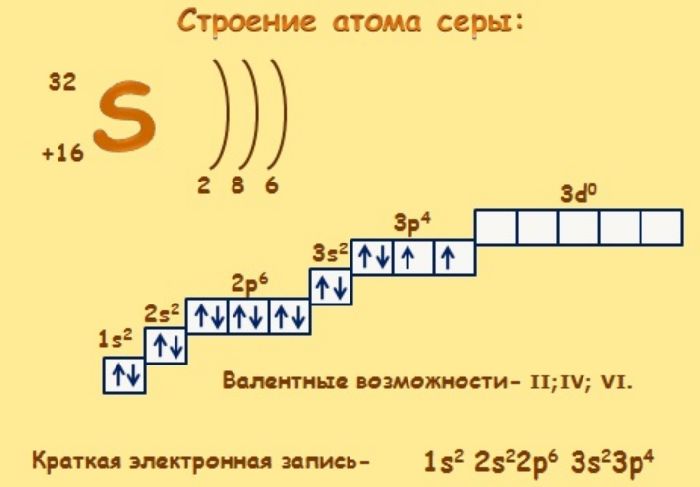
Такие состояния атома называются возбуждёнными. Возбуждённое состояние атома углерода. В отличие от азота, кислорода и фтора у атомов элементов тех же соответствующих главных подгрупп — фосфора , серы и хлора — возможен переход атомов в возбуждённое состояние.
Вследствие этого фосфор, в отличие от азота может быть пятивалентным, сера, в отличие от кислорода — шестивалентной, а хлор, в отличие от фтора — семивалентным. Например, распаривание электронов в атоме фосфора при переходе в возбужденное состояние можно изобразить схемой:. Основное и возбуждённое состояние атома фосфора. A литий B висмут C барий D молибден E алюминий Неверно установлено соответствие:.
A Сахароза — кристаллическое вещество, сладкое на вкус B Фруктоза — сладкое вещество, без запаха C Крахмал — порошок, нерастворимый в холодной воде D Глюкоза — кристаллическое вещество, хорошо растворимое в воде E Целлюлоза — горючее вещество, хорошо растворимое в воде.
Объем водорода при н. A Отдача электронов атомом, молекулой или ионом B Присоединение электронов C Перемещение электронной пары D Образование общей электронной пары E Завершение внешнего энергетического уровня. Нагревание или использование другого вида энергии всегда необходимо для протекания A Реакции ионного обмена B Любой реакции вообще C Эндотермической реакции D Окислительно-восстановительной реакции E Экзотермической реакции.
Число электронных слоёв в атоме элемента, содержащего в ядре 20 протонов: A 3 B 6 C 4 D 5. Вычислите массу цинка. Е 6,57 г Сумма всех коэффициентов полного ионного уравнения взаимодействия оксида серы VI и гидроксида натрия образуется средняя соль A 9 B 8 C 7 D 6 E 5. A 1s2 2s2 2p6 3s2 3p1 B 1s2 2s2 2p6 3s2 3p2 C 1s2 2s2 2p6 3s2 3p5 D 1s2 2s2 2p6 3s2 3p3 E 1s2 2s2 2p6 3s2 3p6 2.
Уравнение диссоциации нитрата магния. При реакции соединения: A в реакцию вступают два сложных вещества, при этом они обмениваются своими составными частями B из одного вещества образуется несколько более простых веществ C простое вещество реагирует с более сложным, при этом образуется два сложных вещества D из нескольких веществ образуется одно более сложное вещество E в реакцию вступают простое и сложное вещества, при этом атомы простого вещества замещают одни из атомов сложного 4.
Количество вещества нитрата аммония, которое образуется при пропускании 11,2 л аммиака н. A 0,5 моль B 1 моль C 2 моль D 5 моль E 0,2 моль. Для полной нейтрализации раствора, содержащего 14 г гидроксида калия, необходим оксид серы IV объемом при н. Не происходит выпадение осадка в случае взаимодействия A силиката натрия и нитрата кальция B сульфата калия и нитрата бария C карбоната калия и нитрата натрия D хлорида натрия и нитрата серебра E сульфида калия и нитрата меди II.
E 55 Электронная конфигурация атома калия A 1s2 2s2 2p6 3s2 3p6 3d10 4s1 B 1s2 2s2 2p6 3s1 C 2s2 2s1 D 1s2 2s2 2p1 E 1s2 2s2 2p6 3s2 3p6 4s2 2. В образовании металлической кристаллической решетки принимают участие A Электроны, анионы, атомы B Только катионы металлов C Только атомы металлов D Только электроны E Электроны, катионы, атом 3.

При окислении происходит. Реакция замещения:. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и хлорида кальция составляет: A 32 B 30 C 25 D 18 E 12 8. Кислые соли состоят из A катионов металлов и кислотных остатков B кислотных остатков и гидроксогрупп, связанных с катионами C двух химически разных катионов и кислотного остатка D кислотных остатков с незамещенными ионами водорода и катионов металлов E внешней и внутренней сферы, которая включает комплексообразователь и лиганды Вид связи в оксидах углерода II и IV.
При взаимодействии 3 моль оксида алюминия и г серной кислоты, получится количество вещества соли в молях A 2 B 3 C 5 D 4 E 1. Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом н.
Если смещать 5 г соли и 95 г воды, то получится …. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и нитрата серебра составляет:. Реакция ионного обмена, идущая до конца. При электролитической диссоциации оснований:.