Таблица электроотрицательности металлов, Таблица электроотрицательности химических элементов по Лайнусу Полингу

Габриелян О. Степени окисления Измайлов, М.
Окраска индикаторов в различных средах. Качественные реакции на неорганические вещества. Плотность водных растворов кислот и щелочей.

Степени окисления химических элементов. Электроотрицательность элементов по Л. С развитием современных представлений электрохимии главным образом в работах Вальтера Нернста стало ясно, что эта последовательность соответствует «ряду напряжений» — расположению металлов по значению стандартных электродных потенциалов.
Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов. Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе.
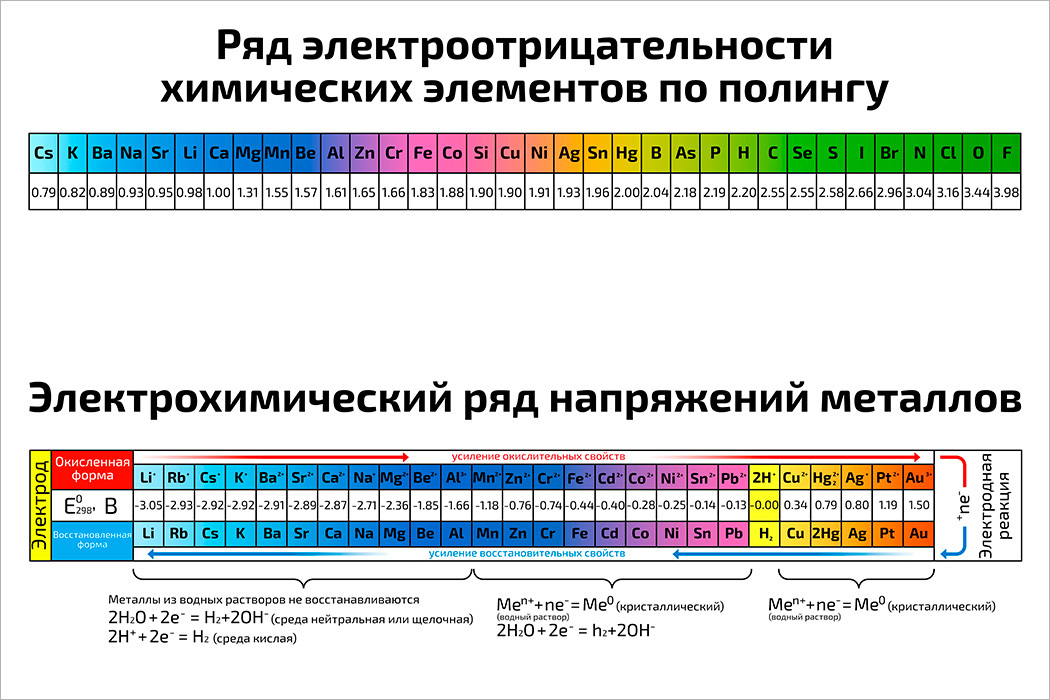
Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов. В самом общем виде ясно, что металлы, находящиеся в начале периодов, характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений.
При этом чередование щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода. Ряд напряжений используется на практике для сравнительной [относительной] оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе :. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 6 января года; проверки требует 1 правка.
Этот раздел не завершён.

Вы поможете проекту, исправив и дополнив его. Алхимия как феномен средневековой культуры.

Пути развития химии: в 2-х томах. Том 2. Николай Николаевич Бекетов — выдающийся русский физико-химик и металлург. Ряд активности металлов Бекетова: миф или реальность?
Труды Н. Свойства растворов. Электродные процессы. Ссылки на внешние ресурсы. Большая датская. Периодическая система химических элементов Д. Электрохимический ряд активности металлов. Категории : Электрохимия Списки химических элементов. Пространства имён Статья Обсуждение.