Гидрат аммиака формула, Гидрат аммиака | это Что такое Гидрат аммиака?

Политика конфиденциальности и Условия использования. Гидроксид аммония получают путем пропускания газообразного аммиака NH3 в воду. В быту аммиачную воду применяют для очистки стёкол, мебели, текстиля.
Никель Никель. Медь Медь. Цинк Цинк. Галлий Галлий. Германий Германий. Мышьяк Мышьяк. Селен Селен. Бром Бром. Криптон Криптон.

Рубидий Рубидий. Стронций Стронций. Иттрий Иттрий. Цирконий Цирконий. Ниобий Ниобий. Молибден Молибден.
Технеций Технеций. Рутений Рутений. Родий Родий. Палладий Палладий. Серебро Серебро. Кадмий Кадмий. Индий Индий. Олово Олово. Сурьма Сурьма. Теллур Теллур. Иод Иод. Ксенон Ксенон. Цезий Цезий. Барий Барий. Лантан Лантан.
Церий Церий. Празеодим Празеодим. Неодим Неодим. Прометий Прометий. Самарий Самарий. Европий Европий. Гадолиний Гадолиний. Тербий Тербий. Диспрозий Диспрозий. Гольмий Гольмий. Эрбий Эрбий. Тулий Тулий. Иттербий Иттербий. Лютеций Лютеций.
Гафний Гафний. Тантал Тантал. Вольфрам Вольфрам. Рений Рений. Осмий Осмий. Иридий Иридий. Платина Платина.

Золото Золото. Ртуть Ртуть. Таллий Таллий. Свинец Свинец. Висмут Висмут. Полоний Полоний. Астат Астат. Радон Радон. Франций Франций. Радий Радий. Актиний Актиний. Торий Торий. Протактиний Протактиний. Уран Уран. Нептуний Нептуний. Плутоний Плутоний. Америций Америций. Кюрий Кюрий. Берклий Берклий. Калифорний Калифорний. Эйнштейний Эйнштейний. Фермий Фермий. Менделевий Менделевий. Нобелий Нобелий. Лоуренсий Лоуренсий. Гидроксид аммония используется в качестве моющего и дезинфицирующего средства во многих бытовых и промышленных чистящих средствах.
Гидроксид аммония также используется в производстве таких продуктов, как удобрения, пластик, вискоза и резина. Водный аммиак вызывает коррозию алюминиевых сплавов, меди, медных сплавов и гальванизированных поверхностей. Водный аммиак - отличный нейтрализатор кислоты. Гидроксид аммония представляет собой бесцветный жидкий раствор с характерным резким запахом.
Растворы гидроксида аммония являются щелочными растворами, что означает, что они имеют высокий уровень pH. В результате гидроксид аммония является сильным раздражителем глаз, кожи и дыхательных путей и легко обжигает ткани, с которыми контактирует. Брызги в глаза могут быть серьезными, так как контакт может вызвать сильные ожоги, раздражающую боль и, возможно, слепоту. Прямой контакт с кожей может вызвать серьезные ожоги, если химическое вещество быстро не смыть большим количеством воды.
Вдыхание тумана гидроксида аммония может вызвать раздражение носа и горла с такими симптомами, как жжение, кашель, удушье и боль.
Вдыхание концентрированного тумана может вызвать отек легких и шок. Проглатывание гидроксида аммония может вызвать боль и ожоги пищевода и желудочно-кишечного тракта. Гидроксид аммония умеренно токсичен для водных организмов. Это может повысить pH в экосистемах, которые плохо защищены. Пары аммиака в концентрациях выше, чем в обычных бытовых чистящих средствах, раздражают глаза, слизистые оболочки и легкие. Оральное употребление аммиака может вызвать ожоги рта, горла и желудка.
Поскольку аммиак имеет сильный неприятный запах и вкус, случайное проглатывание маловероятно. В производстве мебели гидроксид аммония используется для затемнения или окрашивания древесины, содержащей дубильную кислоту. В производстве пищевых продуктов гидроксид аммония используется в качестве разрыхлителя или регулятора кислотности и классифицируется Управлением по контролю за продуктами и лекарствами как общепризнанный безопасный GRAS.
Гидроксид аммония также используется для обработки соломы, в результате чего получается «аммонизированная солома», пригодная в пищу для крупного рогатого скота. В табачной промышленности гидроксид аммония используется для улучшения вкуса и в качестве технологической добавки. Аммиак на водной основе используется в лаборатории чаще всего в качестве комплексообразователя и основания в неорганических анализах.
Он может растворять остатки серебра и при использовании с растворами меди II дает темно-синий цвет. Разбавленный гидроксид аммония, также известный как бытовой аммиак, является обычным ингредиентом многих чистящих средств, включая многие формулы для мытья окон.
Помимо использования в качестве ингредиента в очищающих средствах, разбавленный гидроксид аммония также продается как чистящее средство, обычно обозначаемое просто как «аммиак». Его часто продают с ароматом лимона или сосны. Поскольку гидроксид аммония используется во многих продуктах, он регулируется различными государственными органами в зависимости от количества и типа использования. Гидроксид аммония безопасно и широко используется в течение длительного периода времени. В результате имеется множество данных и информации, позволяющих безопасно обращаться с этим химическим веществом и использовать его.
В водном растворе аммиак депротонирует небольшую часть воды с образованием аммония и гидроксида в соответствии со следующим равновесием:. Как и другие газы, аммиак проявляет снижение растворимости в жидкостях-растворителях при повышении температуры растворителя.
Плотность растворов аммиака уменьшается по мере увеличения концентрации растворенного аммиака.

При более высоких температурах молярность насыщенного раствора уменьшается, а плотность увеличивается. При нагревании насыщенных растворов выделяется газообразный аммиак. Аммиак - это обычное и важное химическое соединение, состоящее из азота и водорода, также известное как NH3. Это химическое вещество, которое содержится во многих местах в природе, необходимо для многих организмов, участвующих в круговороте азота и в процессе производства отходов организма. Организмы производят аммиак и аминокислоты, когда организм расщепляет белки во время пищеварения, частично это делают некоторые пищеварительные бактерии.
Аммиак необходим для синтеза ДНК и особенно белков. В целом организм производит в среднем около 17 граммов или 0,5 унции аммиака, который затем либо всасывается в систему кровообращения около 4 граммов , либо выводится с мочой, вырабатываемой печенью. Гидроксид аммония представляет собой прозрачный бесцветный водный раствор, состоящий из газообразного аммиака, растворенного в воде.
Соединение не существует ни в каком другом состоянии. Гидроксид аммония имеет сильный резкий удушающий запах, вызванный выделением газообразного аммиака из раствора. Большинство растворов гидроксида аммония имеют концентрацию от менее одного процента до примерно 35 процентов аммиака.
Для большинства коммерческих целей самая низкая концентрация аммиака в воде составляет около 10 процентов. Гидроксид аммония получают путем пропускания газообразного аммиака NH3 в воду. После приготовления растворы гидроксида аммония обычно очень стабильны. Существуют всевозможные природные соединения аммиака, которые можно найти в окружающей среде. Вещества, содержащие аммиак или похожие, называются аммиачными, например:.
Использование гидроксида аммония тесно связано с использованием газообразного аммиака, из которого он сделан. Преимущество использования гидроксида аммония перед аммиаком состоит в том, что реагент аммиак легче контролировать, если он растворен в воде, чем когда он доступен в виде газа.
Опасность для здоровья, которую представляет гидроксид аммония, является следствием присутствия в растворе аммиака. При контакте с воздухом такие растворы имеют тенденцию выделять некоторое количество газообразного аммиака, которым пользователи могут вдыхать. Затем этот газ может вызвать раздражение глаз, носа и горла, что для слабых растворов обычно неприятно, но не опасно. Воздействие более высоких концентраций аммиака, выделяемого из гидроксида аммония, может привести к более серьезным проблемам со здоровьем, таким как сильное ожог глаз, носа и горла и необратимое повреждение этих частей тела, включая слепоту, болезни легких и смерть.
Одна из самых опасных опасностей, связанных с гидроксидом аммония, возникает, когда он смешивается с веществами, содержащими хлор, такими как отбеливающие средства. Эта комбинация может привести к выделению большого количества тепла и токсичных газов, которые могут вызвать серьезные травмы и даже смерть. Когда вы смешиваете эти два прозрачных раствора вместе, они реагируют с образованием нового соединения.
Квасцы содержат алюминий. Когда квасцы вступают в реакцию с аммиаком, в качестве продукта реакции образуется гидроксид алюминия Al OH 3. Аммиак очищает полы, микроволновые печи и духовки с пригоревшими продуктами. Но аммиак - эффективный очиститель, и при правильном обращении он безопасен.
Аммиак можно эффективно использовать в качестве чистящего средства для зеркал и стекол, и он дешев по сравнению с некоторыми другими чистящими средствами. Основание - это любая молекула, которая принимает протон, а кислота - это любая молекула, которая выделяет протон.
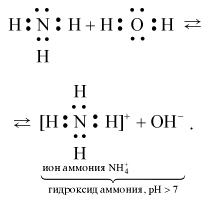
По этой причине аммиак считается основным, потому что его атом азота имеет электронную пару, которая легко принимает протон. Однако аммиак классифицируется как слабое основание, которое представляет собой химическое соединение, которое не полностью распадается на ионы в водном растворе. Когда молекулы распадаются на ионы, этот процесс называется диссоциацией.
В результате образуется другая химическая структура, которая превращается в слабое основание или сильную кислоту и наоборот. Аммиак изначально не содержит гидроксид-ионов, но когда он растворяется в воде, он приобретает ионы водорода из воды, чтобы произвести гидроксид, а также ионы аммония. Однако аммиак не полностью превращается в гидроксид и ионы аммония в растворе, поэтому он считается слабым основанием.
Из-за того, что не все молекулы были разрушены, диссоциация считается неполной, поскольку только очень незначительный процент фактически произвел гидроксид-ионы из молекул аммиака. Теперь, когда основания или кислоты классифицируются как сильные или слабые, эта классификация имеет смысл только в отношении того, как определяется концентрация данного химического вещества в реакции.
Он не описывает, насколько они реакционноспособны, окисляющие или едкие. Сильные основания могут быть такими же едкими и опасными, как сильные кислоты. Возьмем, к примеру, безводный аммиак: у него уровень pH около 11,6, но он по-прежнему вызывает химические ожоги и вызывает сильное раздражение слизистых оболочек, кожи и глаз, точно так же, как воздействие соляной кислоты pH 0 вызывает коррозию. Аммиак относится к классу легковоспламеняющихся газов на уровне 1; однако он может легко воспламениться или вызвать взрывную реакцию в подходящих условиях также как и большой источник энергии.
Эти контейнеры предотвращают быстрое испарение жидкости, поскольку она считается чрезвычайно опасным материалом. При нагревании контейнеры могут взорваться из-за повышения давления конденсированного аммиака.
Взрывы контейнеров обычно не представляют проблемы на открытом воздухе, поскольку летучие химические вещества относительно быстро рассеиваются в воздухе. Однако, если это происходит в помещении, оно остается и представляет собой огромный риск для рабочих, поскольку пар может вызвать обморожение и ужасные химические ожоги дыхательной системы и кожи.
Если контейнер с концентрированным аммиаком взорвется в помещении, есть несколько вещей, которых следует остерегаться помимо телесных повреждений, которые могут создать еще большую опасность для рабочих и другого оборудования предприятия. Несовместимые материалы являются здесь проблемой, если они находятся в непосредственной близости от этой неисправности контейнера, это может увеличить риск пожара и связанных с ним взрывов.
Эти материалы:. Следует также отметить, что при более высоких температурах концентрированный аммиак разлагается на легковоспламеняющийся водород и чрезвычайно токсичный диоксид азота. Обычно используемыми средствами пожаротушения являются сухие химические вещества, CO2, водяная струя или спиртоустойчивая пена, если поток газа невозможно остановить.
Те, кто пытается остановить пожар, должны носить противопожарную одежду, а также дыхательные аппараты с положительным давлением, а те, у кого нет СИЗ, должны уйти как можно быстрее, опасаясь воздействия опасности или даже смерти. В целом, когда речь идет о воспламеняемости концентрированного газообразного аммиака, можно сделать вывод, что сам по себе газ не является особенно легковоспламеняющимся, однако вещества, которые потенциально могут взаимодействовать с газообразным аммиаком, создают чрезвычайно легковоспламеняющийся и взрывоопасный материал.
Вдыхание: могут возникнуть ожоги носоглотки и трахеи, отек бронхов и альвеол, разрушение дыхательных путей, что может привести к дыхательной недостаточности.
Проглатывание: При проглатывании гидроксида аммония он может вызвать разъедание рта, горла и желудка.